
2020/11/25 系统管理员
Biacore T200代表了Biacore产品家族的最新研发成果,它具有最高的灵敏度和最低的噪音,在仪器的灵敏度和应用的多样性方面有了显著的改善。
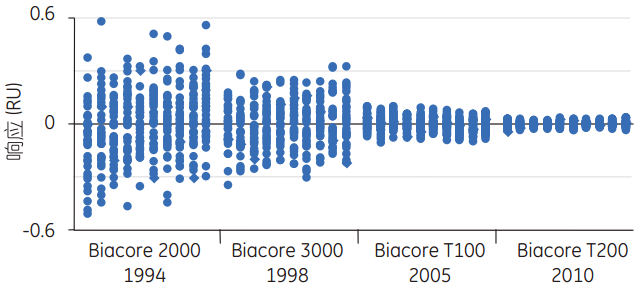
图1 Biacore仪器的短期噪音比较
(一)T200技术参数
技术项目 | 参数 |
检测原理 | 表面等离子共振原理(SPR) |
获取的信息 | 动力学、亲和力、特异性、活性浓度、热力学等 |
样品类型 | 从低分子量化合物到生物大分子如蛋白、多肽、DNA、RNA、多糖、脂类分子以及细胞及病毒,含DMSO等有机溶剂的缓冲液,血清及胞浆上清液等 |
结合速率常数(ka) | 103-3X109 M-1S-1 |
解离速率常数(kd) | 10-5-1 S-1 |
平衡常数(KD) | 10-4-3.3X10-15 M |
分析温度 | 4-45℃ |
分子量下限 | 对有机化合物无分子量限制 |
样品折射率范围 | 1.33-1.40 |
动态范围 | 1-70000 |
基线噪音 | < 0.03 RU (RMS) |
浓度测定 | 标准曲线法或CFCA法 |
(二)T200性能表现
一、扩展非标记相互作用分析的检测极限
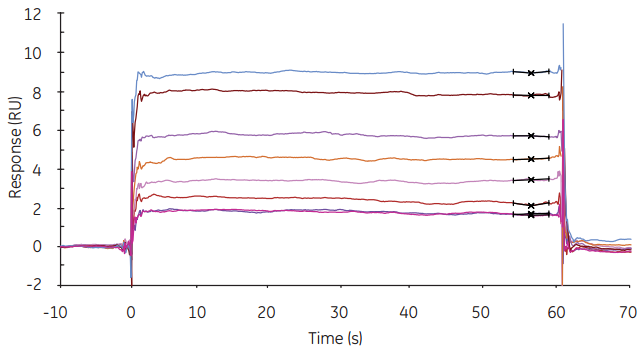
图2 甲基磺酸(Mr 95)与碳酸酐酶的相互作用特性
Biacore T200专为要求高灵敏度的分子间相互作用的分析而设计:
1)小的有机化合物(无最低分子量限制)
2)低丰度分子(浓度大于10pM)
3)稀有或敏感的靶蛋白,如G蛋白偶联受体
4)避免了分析与二价抗体之间相互作用时亲和效应的干扰
5)微弱相互作用分析,KD在mM范围内
6)稳定的结合物,kd≥10-5 S-1
1、测定稀有或敏感靶蛋白
从低水平捕获蛋白获取高质量数据有利于分析小分子和诸如G蛋白偶联受体等敏感蛋白的相互作用,而这些蛋白往往是最重要的药物靶蛋白。而Biacore T200的高灵敏性意味着蛋白固定后仅需小部分分子保留活性即可用于分析。此外,稀有靶蛋白使用量较少,使得消耗降低的同时并不影响数据质量。敏感靶蛋白的研究因此更加可信,缩短了药物发现过程中的检测时间。
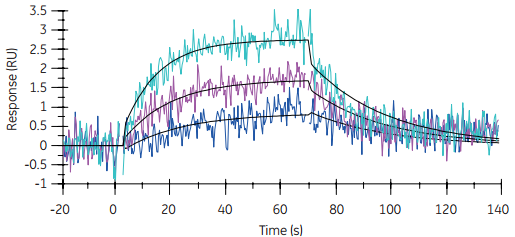
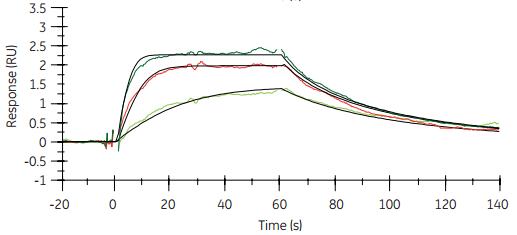
图3 小分子黄嘌呤胺同源物(XAC)与组氨酸标记GPCR(STaRR)A2的结合。当使用低水平固定GPCR时,采用Biacore T200(右图)可生产质量优于Biacore T100(左图)的数据。
2、分析方法设计更加灵活
在评估抗体用作治疗、分析或诊断工具的适用性时,对抗原-抗体相互作用进行全面特征鉴定很重要。当利用Biacore进行抗原-抗体分析时,通常情况下建议将抗体固定于传感器表面以免其亲和作用(Avdity Effect)影响数据解读。然而,在特定情况下,人们更倾向于固定抗原,这是出于节约珍贵靶分子的考虑或抗原分子更易于固定。Biacore T200的高灵敏度足以降低抗原捕获水平以避免亲和效应,进而使得分析方法的设计可以灵活多样。
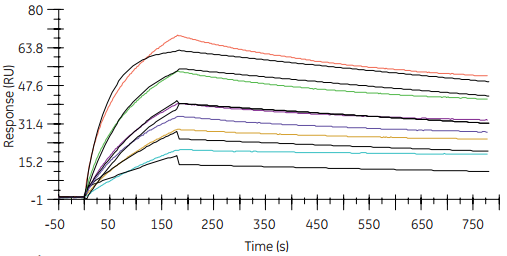
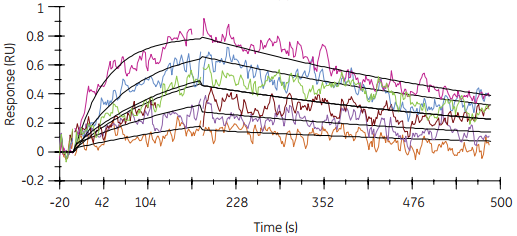
图4 在抗原低捕获水平上(右图)分子间相互作用数据更适合1:1模型。从而以抗体为配体的相应动力学常数的计算更加精确、可靠。
3、更广动力学范围内的高度精确性分析
Biacore T200中的微流控系统经过优化以用于高质量的动力学分析。四个流动池可灵活用于单一的、配对的或者系列运行。配对的芯片上流动池接口使得流动池之间的空间被降到最低水平,确保了精确的标准差减。
Biacore T200可以测定从最快的结合速率到最慢的解离速率的最广范围内的动力学常数。这可用于对强结合物进行排序,这一点对于抗体筛选非常重要。此外还可以用于检测快速结合的相互作用物之间的差别,这在收到生物利用率限制的生物学过程的研究中非常重要。
1)ka从103到5X107M-1s-1(对于大分子待检物为103到3X109 M-1s-1)
2)kd从10-5到1s-1
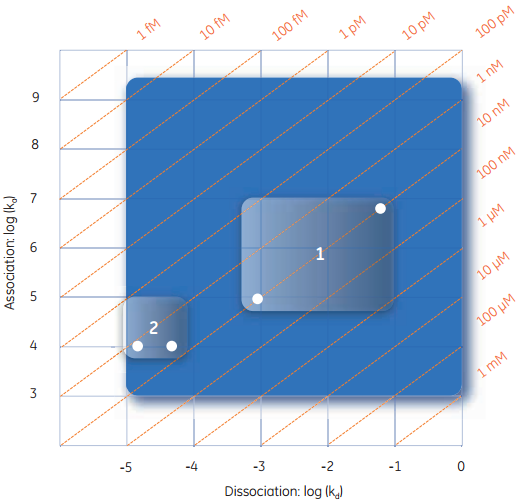
图5 从最快结合速率到最慢解离速率的最大范围内动力学参数测量。具有明显类似亲和力的相互作用具有极其不同的动力学特性。
二、性能范围
1、自动运行条件下可分析高达384种样品
Biacore T200支持96和384孔板和小瓶的使用。四个流动池的使用使得四种相互作用可被同时检测。Biacore T200的样品槽可以降温到4℃,使得敏感样品可以在高达48小时无人值守的运行中得以分析。
2、在生理温度下研究分子间相互作用来预测体内状态的情况
通过提高在生理温度下测定的可靠数据,Biacore T200确保更加准确地预测体内状态下的治疗性分子的特性。系统一体的缓冲液除气装置防止在温度升高的情况下形成气泡,有助于确保更高质量的数据。此外,一体的除气装置也可以省略运行前对缓冲液进行的除气操作。
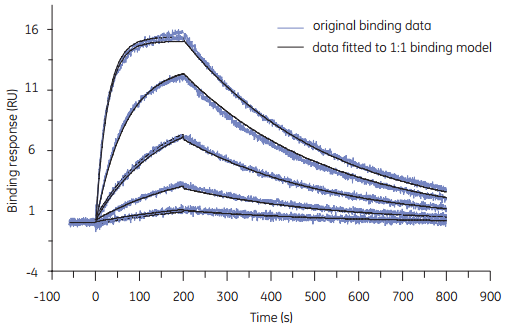
图6 Biacore T200在37℃时提供稳定和可重复的数据。
3、运行缓冲液筛选有助于快速分析方法开发
内置的缓冲液选择装置在每次运行中可最多测试四种缓冲液,加快了分析方法的开发。例如,结合特性的微环境效应可在机制性和稳定性研究中进行分析。
4、回收样品以用于质谱鉴定
Biacore T200结合质谱为在功能性结合标准的基础上鉴定蛋白质提供了可能。样品的回收及消化均具有软件支持。
1)被分析物以很小的体积被回收,使得浓度最大化。
2)从样品到回收溶液尽可能减少残留。
3)在含有消化溶液的瓶中沉淀。
4)软件模板预先设置有整个回收过程。
三、快速、简单的动力学分析
Biacore T200软件为可信的和准确的动力学分析上提供了广泛的工具。可使用多循环方法;或者采用单循环动力学分析:由于不需要进行每次注入样品之间的表面再生过程,单循环动力学分析使得那些涉及难以再生的靶蛋白分析能够实现,并且缩短了分析开发的时间。
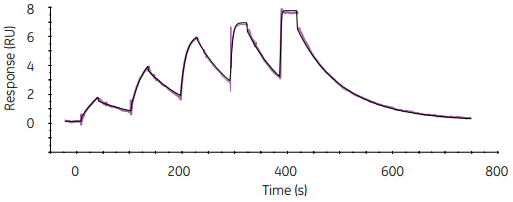
图7 使用单循环动力学分析方法,样品在无需中间再生步骤的情况下逐个被加入到同一个循环中。
Biacore T200数据评估软件可使分子间相互作用的动力学分析通过几个简单的点击来实现。
1)同时处理多重样品以简化数据分析过程并且节省时间
2)使用一个或几个现有的相互作用模型拟合动力学数据
3)自动减去参照和空白对照数据
(三)经典应用
1、绘制凋亡信号通路
通过研究点突变凋亡蛋白和细胞表面受体之间的相互作用可以揭示出细胞内的信号传导通路。
研究表明,凋亡蛋白LIGHT可与两种细胞受体:淋巴细胞毒素-β受体(LTβR)和疱疹病毒穿入介质(HveA)相结合。通过在可能参与受体结合的肽环处引入点突变,Biacore方法可考查这些突变对LIGHT蛋白结合特性的影响。
实验对野生型和LIGHT突变体与其受体间的相互作用分别进行了研究。通过抗体捕获技术讲HveA蛋白和LTβR蛋白固定于传感芯片表面。体外分析发现,其中一种LIGHT突变体可以与HveA蛋白结合,却不能与LTβR蛋白相结合,也没能导致靶细胞的凋亡。这些结果有力的暗示,LIGHT通过与其细胞表面受体相互作用时至少激活了两条不同的信号通路,而且只有其中一条通路会引发凋亡。
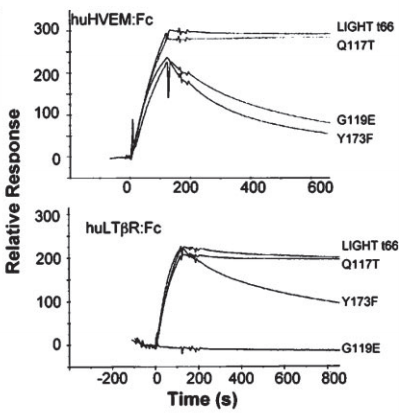
图8 LIGHTt66蛋白突变体Q117T与HveA蛋白结合(上),而不与LTβR蛋白结合(下)。
Reference: Rooney, I. A. et al. The lymphotoxin-β receptor is necessary and sufficient for LIGHT-mediated apoptosis of tumor cells. J. Biol. Chem. 275, 14307–14315 (2000)
2、配体垂钓
从细胞条件培养基中鉴定与细胞表面受体相互作用的可能配体。
将一个含细胞表面受体Flt4胞外域的Fc融合蛋白固定在传感芯片表面。将来自100种不同细胞系的浓缩培养基流经芯片表面。当把这些培养基用生物学方法检测时,只有在Biacore实验中能与Flt4结合的培养基才能够诱导稳定转染的CHO细胞中的Flt4受体发生酪氨酸磷酸化。
随后,经过亲和层析柱的分离和SDS-PAGE电泳,三种与Flt4结合活性相关的多肽被收集。
由收集到的其中两种肽段中部分氨基酸序列合成变性PCR引物,扩增出一个65 bp的产物。测序结果显示,该产物中含有一段和已知氨基酸序列完全匹配的序列。这段cDNA被用来鉴定Flt4的配体,确认该蛋白在新转染细胞中的生物功能,同时还可以用于发现与其功能相关的生长因子的同源区域,从而研究这些配体的基因表达状态。
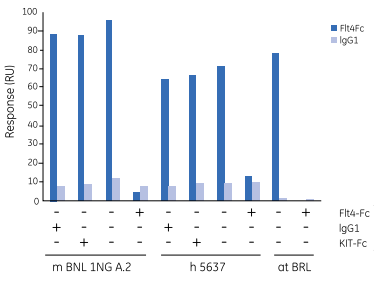
图9 与Flt4-Fc特异结合的三种细胞条件培养基(CM)。当CM与过量的Flt4-Fc(非人IgG-Fc)共注射时,该信号被抑制。
Reference: Fitz, L. J. et al. Characterization of murine Flt4 ligand/VEGF-C. Oncogene 15, 613–618 (1997)
3、蛋白-蛋白相互作用
研究多组分蛋白复合体对生物过程的调节
补体旁路(alternative complement)蛋白C3b部分受到血浆蛋白因子H(fH)的调节。通过对fH与表面结合蛋白C3b相互作用位点进行鉴定,有助于理解补体旁路为什么只会被异己组织激活。
将C3b连同其蛋白水解片段C3c和C3d固定于芯片表面。 将8个fH片段通过注射流经芯片表面,结果发现血浆蛋白因子H (fH) 上存在三种不同的与C3b结合的位点。
每个fH片段都与C3b上不同的位点相互作用。位点1仅与完整的C3b作用,位点2与C3b和C3c结合,而位点3与完整C3b和C3d片段结合。C3b和fH之间的多重交互作用对于理解补体旁路与异体和宿主结构之间存在的专一反应性提供了分子基础。
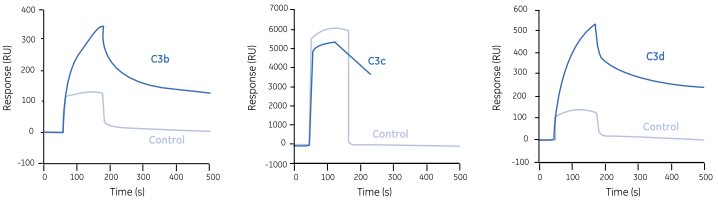
图10 fH位点3仅与完整C3b和其片段C3d相结合
Reference: Jokiranta, T. S. et al. Each of the three binding sites on complement factor H interacts with a distinct site on C3b. J. Biol. Chem. 275, 27657–27662 (2000)
4、Biacore系统与质谱
Biacore系统与电喷雾串联质谱技术(ESI-MS/MS)联合为研究者提供一种新的分析方法,用来捕获发生相互作用的蛋白并进行回收与鉴定。该技术提供了一整套包含检测、捕获及回收中低飞摩尔量级蛋白的方法。
将三磷酸肌醇(IP3)固定在芯片表面,将转化有IP3结合蛋白的细菌裂解物流经芯片表面。随后,通过空气隔断的方法(air partition method)将微量的胰酶送至结合蛋白处进行消化。酶解的肽段通过反相毛细管柱富集并除去了可能干扰质谱分析的杂质。从反相上洗脱的肽段混合物通过液质联用串联质谱系统进行分析,最终确定IP3结合蛋白的存在。
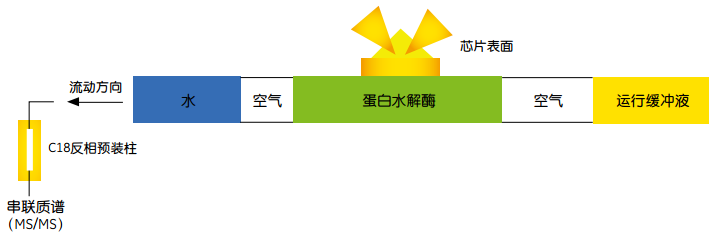
图11 表面在位消化原理。与芯片表面结合的蛋白质经蛋白酶原味消化和毛细管柱富集后进行串联质谱MS/MS分析。
Reference: Natsume, T. et al. Combination of biomolecular interaction analysis and mass spectrometric amino acid sequencing. Anal. Chem. 72, 4193–4198 (2000)
5、检测临床实验中治疗抗体的免疫源性
作为治疗药物,小鼠抗体由于会激起机体免疫应答而受到限制。纽约Ludwig肿瘤研究中心的研究人员构建出一个人源化的小鼠单克隆抗体药物,该药物将CDR区域嫁接进人IgG骨架,能识别人结肠上皮和结肠癌中特异表达的一种标记物。这种嵌合抗体在患有结肠癌的病人身上进行I期和II期临床检测,其免疫源性通过无标记蛋白相互作用分析进行监控。
将人源化抗体(huAb A33)固定在传感芯片表面,并在制备好的芯片表面注入病人的血清。反应人群被大体划分为两大类。 I型反应人群的特点是在2周时间内血清中出现有抗huAb A33的抗体,尽管病人持续接受huAb A33治疗,但抗huAb A33抗体的滴度开始不断下降。而另一边,II型反应人群的免疫应答反应较缓慢,但随着治疗的继续,抗体滴度持续增加。在后一组中,生理性不良反应比I型更加频繁,因此,最终停止了使用huAb A33对这些病人进行治疗。
此外,病人抗体响应的亚类也可通过Biacore夹心检测进行鉴定。简言;所有病人样品当预先将蛋白G加入稀释血清后(去除IgG)其抗huAb A33反应几近消失,而有一些病人采用正辛酸处理(沉淀所有的非IgG蛋白)则没有太大的影响。极少的病人在用蛋白G处理血清后仍有残留的活性存在,这些信号可通过向传感芯片表面注入抗IgM抗体检测到。
具有II型反应的病人数周内都没有出现不良生理症状,直到几周后,用Biacore检测到抗huAb A33抗体水平持续增加。因此研究人员可以采用无标记蛋白相互作用分析对可能出现的不良反应进行预测。
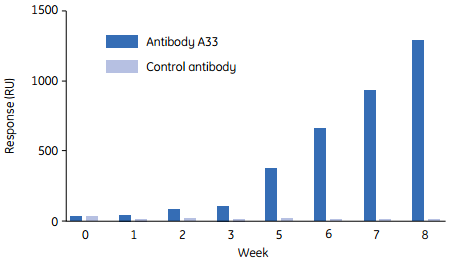
图12 II型病人体内人源化抗体的应答水平与单个病人所发生的临床免疫化学参数改变和不良反应之间的关联。
Reference: Ritter, G. et al. Serological analysis of human anti-human antibody responses in colon cancer patients treated with repeated doses of humanized monoclonal antibody A33. Cancer Res. 61, 6851-6859 (2001)
(四)实际案例
1、蛋白-蛋白相互作用
配体:蛋白HSA
分析物:蛋白HE,~6KDa
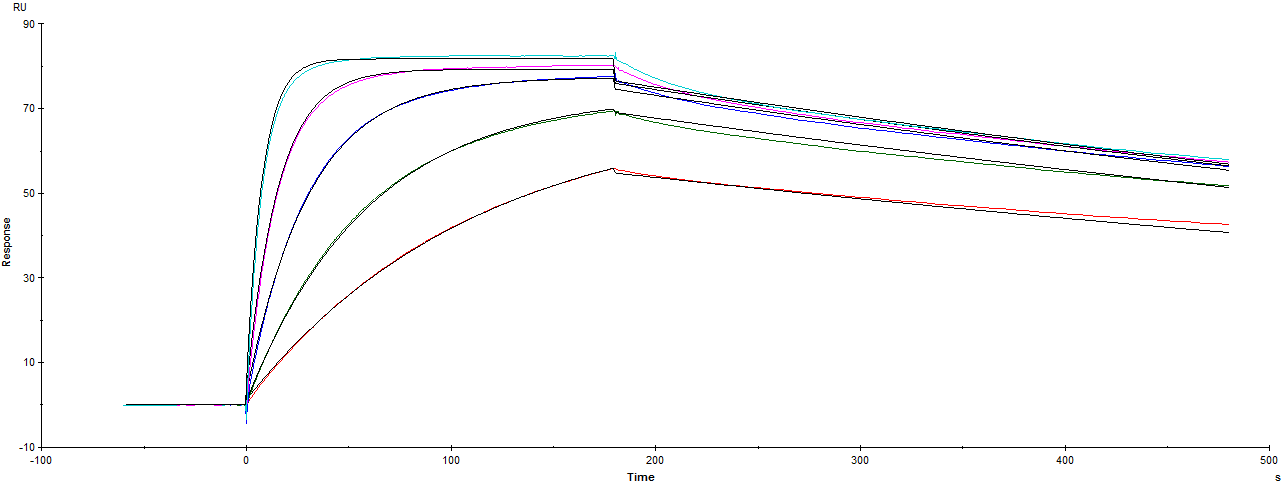
ka(1/Ms)=2.434*E5 kd(1/s)=9.89*E-4 KD(M)=4.064*E-9
SE(Ka)=3.9*E+2 SE(kd)=1.3*E-6
从传感图得知,实验成功监测到信号,信号明显且呈现良好的浓度依赖性。
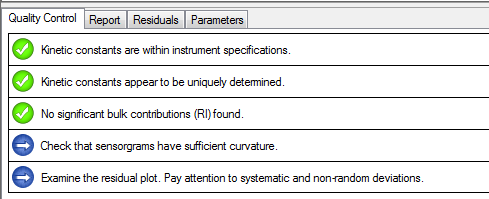
数据QC模块显示数据分析结果合理科学,结果真实可信。
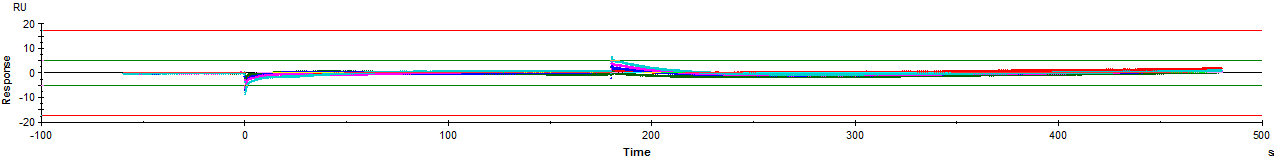
数据Residuals模块表明拟合曲线非常符合实际的数据曲线。
服务联系人:姜丽 0512-62872940 ljiang2007@sinano.ac.cn